2Al + 4H2SO4 → Al2(SO4)3 + S + 4H2O
Bạn đang xem: Al + H2SO4 → Al2(SO4)3 + S + H2O | Al ra Al2(SO4)3
2. Điều khiếu nại phản xạ Al ứng dụng H2SO4 đặc xảy ra
Nhiệt chừng thường
3. Cân vày phản xạ Al + H2SO4 → Al2(SO4)3 + S + H2O vày cách thức thăng vày electron
Al0 + H2S+6O4 → Al+32(SO4)3 + S0 + H2O
|
2x
1x
|
Al0 → Al+3 + 3e
S+6 + 6e → S0
|
Phương trình hóa học
2Al + 4H2SO4 → Al2(SO4)3 + S + 4H2O
4. Bản hóa học của những hóa học nhập cuộc phản ứng
4.1. Bản hóa học của Al (Nhôm)
- Trong phản xạ bên trên Al là hóa học khử.
- Al ứng dụng với những axit sở hữu tính oxi hoá mạnh như hỗn hợp HNO3 loãng, HNO3 đặc, rét và H2SO4 đặc, rét. (Chú ý: Al bị thụ động hoá vô hỗn hợp HNO3 đặc, nguội hoặc H2SO4 đặc nguội)
4.2. Bản hóa học của H2SO4 đặc rét (Axit sunfuric)
- Trong phản xạ bên trên H2SO4 là hóa học oxi hoá.
- Trong H2SO4 thì S sở hữu nút oxi hoá +6 tối đa nên H2SO4 đặc sở hữu tính axit mạnh, oxi hoá mạnh.
5. Tính hóa học hoá học tập của Al
Nhôm là sắt kẽm kim loại sở hữu tính khử mạnh: Al → Al3+ + 3e
5.1. Tác dụng với phi kim
a) Tác dụng với oxi
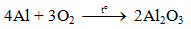
Al bền vô không gian ở nhiệt độ chừng thông thường bởi sở hữu lớp màng oxit Al2O3 đặc biệt mỏng mảnh đảm bảo an toàn.
b) Tác dụng với phi kim khác
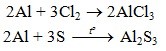
5.2. Tác dụng với axit
+ Axit không tồn tại tính oxi hóa: hỗn hợp axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit sở hữu tính lão hóa mạnh: hỗn hợp HNO3 loãng, HNO3 đặc, rét và H2SO4 đặc, rét.
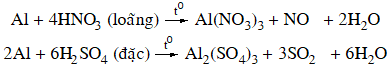
Nhôm bị thụ động hoá vô hỗn hợp HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
5.3. Tác dụng với oxit sắt kẽm kim loại (Phản ứng nhiệt độ nhôm)
Lưu ý: Nhôm chỉ khử oxit của những sắt kẽm kim loại đứng sau nhôm
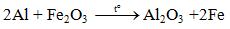
5.4. Tác dụng với nước
Phá vứt lớp oxit bên trên mặt phẳng Al (hoặc tạo ra trở thành lếu hống Al-Hg thì Al tiếp tục phản xạ với nước ở nhiệt độ chừng thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
5.5. Tác dụng với hỗn hợp kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
5.6. Tác dụng với hỗn hợp muối
Al đẩy được sắt kẽm kim loại đứng sau thoát khỏi hỗn hợp muối hạt của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
5.7. Ứng dụng của Nhôm
Máy hạn chế rất đơn giản mò mẫm và những phần tử vô xí nghiệp sản xuất phát triển được sản xuất vày Al. Với đặc điểm sáng sủa và ko rỉ sét, Al dần dần phát triển thành vật tư không thể không có so với từng xí nghiệp sản xuất. Một số sản phẩm được sản xuất vày Al, ví dụ điển hình như: Khung xe pháo máy, sườn xe pháo tương đối, thùng xe vận tải, những cụ thể tản nhiệt độ...
Đặc biệt, Al được dùng vô phát triển vô ngành sản phẩm ko ngoài trái đất. Thân máy cất cánh và cánh được sản xuất vày nhôm. Các phần mềm phụ thuộc vào trọng lượng riêng rẽ nhẹ nhõm và bền của nhôm là đặc biệt quan trọng nhằm tiết kiệm chi phí tối nhiều trọng lượng vô không gian.
6. Tính hóa học hoá học tập của H2SO4
6.1. H2SO4 loãng
Axit sunfuric là một trong axit mạnh, hóa hóa học này còn có không hề thiếu những đặc thù chất hóa học cộng đồng của axit như:
- Axit sunfuric H2SO4 thực hiện thay đổi màu sắc quỳ tím trở thành đỏ lòe.
- Tác dụng với sắt kẽm kim loại đứng trước H (trừ Pb) tạo ra trở thành muối hạt sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo ra trở thành muối hạt mới mẻ (trong cơ sắt kẽm kim loại không thay đổi hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric ứng dụng với bazo tạo ra trở thành muối hạt mới mẻ và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 ứng dụng với muối hạt tạo ra trở thành muối hạt mới mẻ (trong cơ sắt kẽm kim loại vẫn không thay đổi hóa trị) và axit mới mẻ.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
6.2. H2SO4 đặc
Axit sunfuric đặc sở hữu tính axit mạnh, lão hóa mạnh với đặc thù chất hóa học nổi trội như:
- Tác dụng với kim loại: Khi mang lại miếng Cu vô vào H2SO4 tạo nên hỗn hợp được màu xanh rớt và sở hữu khí cất cánh rời khỏi với mùi hương sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo ra trở thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
Xem thêm: Thực vật được chia thành các ngành nào?
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với những hóa học khử không giống.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn tồn tại tính háo nước đặc thù như fake H2SO4 vô ly đựng lối, sau phản xạ lối có khả năng sẽ bị gửi thanh lịch black color và phun trào với phương trình chất hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
7. Câu căn vặn áp dụng tương quan
Câu 1. Nhôm ko phản xạ được với hỗn hợp này bên dưới đây?
A. FeSO4
B. HCl loãng, dư
C. H2SO4 đặc, nguội
D. NaOH
Lời giải:
Đáp án: C
Nhôm bị thụ động vô axit HNO3, H2SO4 đặc nguội
Câu 2. Các dụng cụ vày nhôm bền vô không gian và nước là do:
A. Có một tờ Al(OH)3 phía bên ngoài bảo vệ
B. Có một tờ Al2O3 bên ngoài bảo vệ
C. Nhôm ko tan vô nước
D. Nhôm bền, không xẩy ra oxi hóa
Lời giải:
Đáp án: B
Đồ vật thực hiện vày nhôm bền vô không gian và nước là vì sở hữu màng oxit Al2O3 vững chắc đảm bảo an toàn.
Câu 3. Cách này tại đây ko đập phá diệt những vật dụng thực hiện vày nhôm?
A. Dùng nước cốt chanh rửa sạch mặt phẳng nhôm
B. Rửa sạch sẽ, vệ sinh thô và nhằm vị trí thô ráo
C. Dùng đồ dùng thực hiện vày nhôm nhằm đựng nước vôi
D. Dùng đồ dùng thực hiện vày nhôm nhằm đựng nước biển
Lời giải:
Đáp án: B
Cách ko đập phá diệt những vật dụng thực hiện vày nhôm là: Rửa sạch sẽ, vệ sinh thô và nhằm vị trí thô ráo
Câu 4. Để phân biệt 3 gói bột: Fe, Cu và Al rất có thể sử dụng những dung dịch
A. NaOH và FeCl2
B. HCl và CuCl2
C. Ca(OH)2 và NaCl
D. HCl và NaOH
Lời giải:
Đáp án: D
Trích kiểu mẫu demo và viết số loại tự
Cho những kiểu mẫu demo vô dd NaOH
+ Mẫu demo phản xạ sở hữu khí bay rời khỏi là Al
Al + NaOH + H2O → NaAlO2+ H2↑
+ Mẫu demo ko phản xạ là Fe và Cu
Để phân biệt Fe và Cu tao mang lại 2 kiểu mẫu demo vô hỗn hợp HCl
+ Mẫu demo phản xạ sở hữu khí bay rời khỏi là Fe
Fe + 2HCl → FeCl2 + H2
Câu 5. Sự khác lạ nhất vô đặc thù chất hóa học của H2SO4 đặc đối với H2SO4 loãng là
A. Tác dụng được với oxit bazơ
B. Tác dụng được với bazơ
C. Tác dụng được với muối
D. Khả năng hít nước mạnh (tính háo nước)
Lời giải:
Đáp án: D
Axit sunfuric đặc sở hữu những đặc thù chất hóa học riêng rẽ đối với H2SO4 loãng
+ Tác dụng với đa số sắt kẽm kim loại (trừ Au và Pt)
+ Tính háo nước
Câu 6. Trong công nghiệp, phát triển axitsunfuric qua loa bao nhiêu công đoạn
A. 1
B. 2
Xem thêm: Công thức tính góc giữa hai vectơ (hay, chi tiết).
C. 3
D. 4
Lời giải: